元素周期表简介
元素周期表中共有118种元素,每一种元素都有一个编号,大小恰好等于该元素原子的核内电子数目,这个编号称为原子序数
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在 同一列
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)
共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族
在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强
元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物
关于元素周期表
现代化学元素周期律是由1869年俄国科学家门捷列夫(Dmitri Mendeleev)首先总结而来,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,后来又经过许多科学家多年努力修订了很多版本才形成现代的周期表。
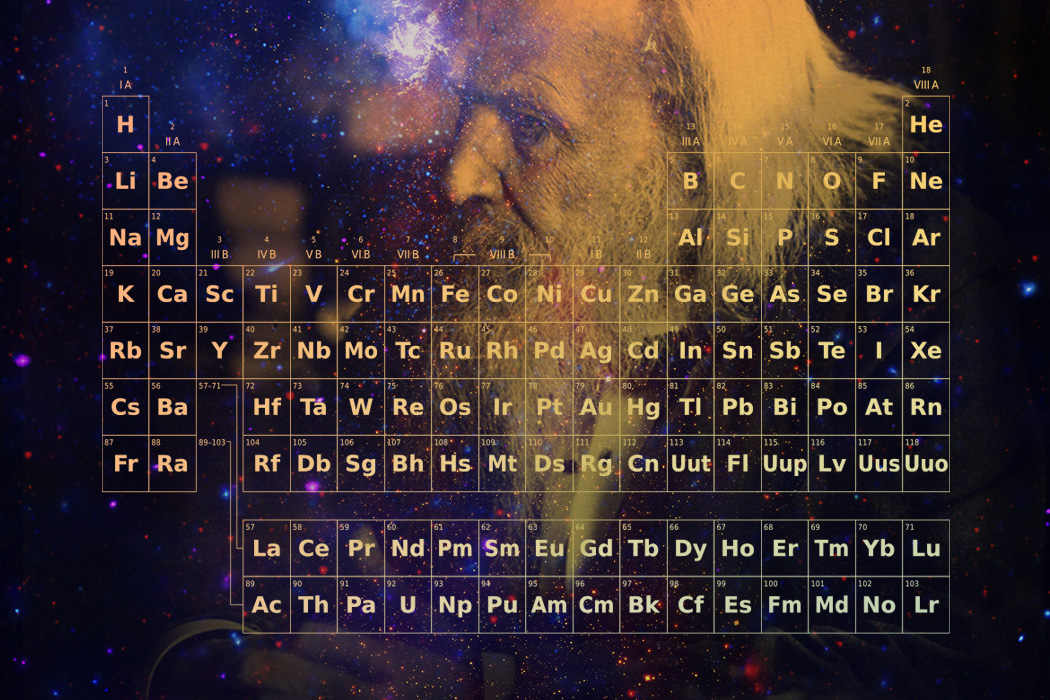
图片:Wikimedia Commons/Jonathan Aprea








