科普驿站 第六十七期
主题:性染色体异变之谜(下)
科目:生物
难度:B2
讲师:杜瑾鸿
从一个科学家的视角来看,这叫山雨欲来风满楼。既然男性特异性区域也存在伴X基因的同源体(但因为已经没有联会和交叉互换了,所以绝非完全相同),只要计算出Y染色体演化的速率,再对两者的相似度加以分析,是不是就可以确定Y染色体开始分化(交叉互换停止)的时间了?——虽然是一个很有意思的思路,不过也是最容易想到的思路。David .C. Page与Bruce Lahn在1999年,第一次做了这个尝试。
两人在1999年的这项工作按照在X与Y的拷贝之间的分化程度,将上面的基因分成了4组——整整4组。这就是他们所谓的进化层(evolutionary strata)——这意味着什么呢,这些基因所在的区域在分异的进程开始之前,经历了交叉互换的消亡。Y染色体曾经经历了4次臂间倒位——这真是细胞世界的破窗效应!这个设想的有力证据就是SRY位于Y染色体短臂,PAR1下方一丁点,而它的同源体SOX3却位于X染色体长臂;位于Y短臂的RPS4Y的同源体RPS4X位于X长臂;ZFX和ZFY则都位于短臂,如此云云。他们还注意到,一些从常染色体上易位而来的mRNA可能发生反转座,从而插入Y染色体而形成了今天的某些男(雄)性特异性基因。
他们还估测了进化层出现的时间:
第一进化层——2.4亿-3.5亿年前(发生在哺乳动物与鸟类的分化以后);
第二进化层——1.3亿-1.7亿年前;
第三进化层——8000万年-1.3亿年前;
第四进化层——3000万-5000万年前。
一个有意思的细节是,SRY是第一进化层的成员。早先,Foster与Graves曾做出猜想,认为SRY与SOX3曾今是一对常染色体上的等位基因,Y染色体上的那个被之前的科学家所描述的进化力量塑造成为今天的性别决定因子SRY。SRY蛋白质有个特殊的空间结构叫做SRY HMG盒子,这个区域的空间结构和氨基酸顺序在人类和千年王八的SRY蛋白那里都相差不多,当然,SRY HMG盒子以外的肽链序列早已变形得掉渣了。而在Lahn和Page的论文中,数据显示,在第一进化层的3个基因中,SRY/SOX3可能比另外两个还要古老,意味着第一进化层可能还可以细分。但作者没有再深入探讨。
后来的研究还发现了一个更加晚近的进化层,即第五进化层,产生于约2400万年前的倒位事件。尽管今天的研究表明,Lahn和Page估测进化速率的方法可能有问题(如杨仙荣(2014)等指出Veyrunes的结果可能更加可信),但正如许多人(包括Ohno本人)估计的那样,Y染色体的衰退起源于倒位事件,而退化的机制,已经为Muller所阐明。这样一来,我们就第一次了解到了Y染色体进化的完整过程。时至今日,Page依然活跃在科研前线,几乎每年保持着三四篇的速度发论文。
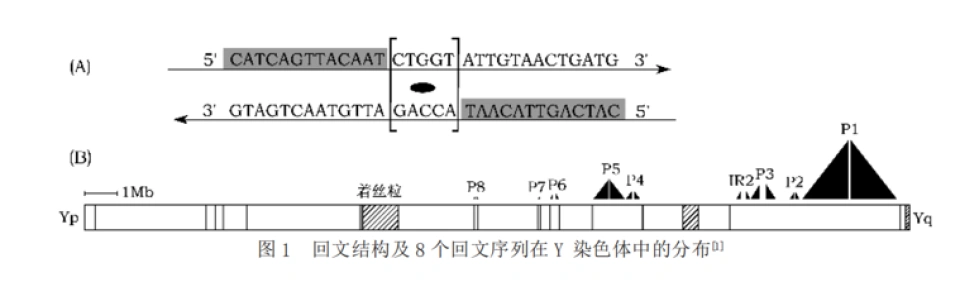
但就在这个时候,测序技术发生了革命。采用人工染色体技术发现的一系列鸟枪序列无法揭示的诡异现象注定了测序技术不会只被用来证明过去的假说。不少人注意到,男性特异性区域里似乎存在大量的重复序列(它们似乎经常被称为卫星DNA)。2001年,Kuroda-Kawaguchi等报道了在Y染色体上的无精子因子c区(AZFc region,定位于Yq11.23(21,400000-26,900000))上出现的大规模回文(palindrome)序列——碱基排列顺序顺着读反着读都一样的DNA片段——当然,不是完美的回文。完美的回文是不能稳定存在的。
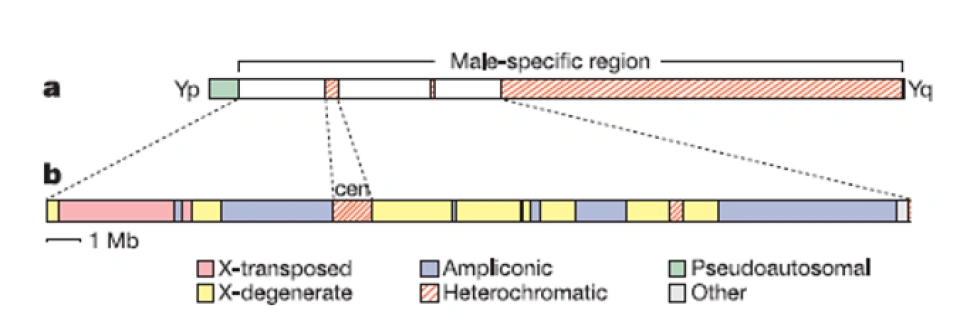
2003年,Nature公布了Y染色体DNA序列及其分析结果。男性特异性区域可以细分为3个常染色质序列组,即X衰变(X-degenerate)区、X转座(X-transposed)区、扩增子(ampliconic)区,如图。或者也可以这样分——常染色质(euchromatic)区和异染色质(heterochromatic)区。
异染色质区占了Y染色体长度的大部分。对于它的长度,科学家有一个估数40Mb,但我看没有那么多,理由见后文。当然,这篇文章大概成为了一个信号,有点像是对2002年Graves和Aitken的文章的回应。后者这篇文章比较著名,主要是因为,作者在本文中做出了一个著名的预测,即Y染色体以如此快的速度退化,那么以至于很可能会在1000万年之内彻底消失。
2003年的研究相当于反驳的声音吗?显然,科学家以前研究的Y染色体上的基因只是位于X衰变区和拟常(pseudo-autosomal)区上的,而这一部分在Y染色体上只占很小的区域,只有8.6Mb(尽管可能构成了Y染色体上最重要的部分)。X转座区与扩增子区则是新发现,它们的长度分别是3.4Mb和10.2Mb。X转座区显示出与X染色体99%的同源性(上面只有两个基因),对此人们认为其进化起源乃是源于X染色体向Y染色体的易位事件,但这个区域只在2%的人群中存在,被称之为“第三个PAR”即PAR3。而扩增子则充满了重复系列,且进化起源可能相当多样。这表示,Y染色体在进化的历程中,还经历了增长和扩充(即Y染色体不是一味削减的),这几乎颠覆了科学家过去对Y染色体的认知。
同时,文章确定了Y染色体上的8个回文结构,命名为P1~8。——尽管不是完美的回文,但是它们的对称两侧臂的DNA序列的同源性达到了99.94%-99.997%。在扩增子区还包含5个大型反向重复序列(两个序列相同的拷贝,在DNA链上呈反向排列,相当于在一个回文的对称点上插入了一部分与之无关的序列,就像把上面那个回文例子ACG[T]GCA改成ACG[GCTTA]GCA,其中ACG和GCA就是反向重复的),只是它们的序列一致性较低。
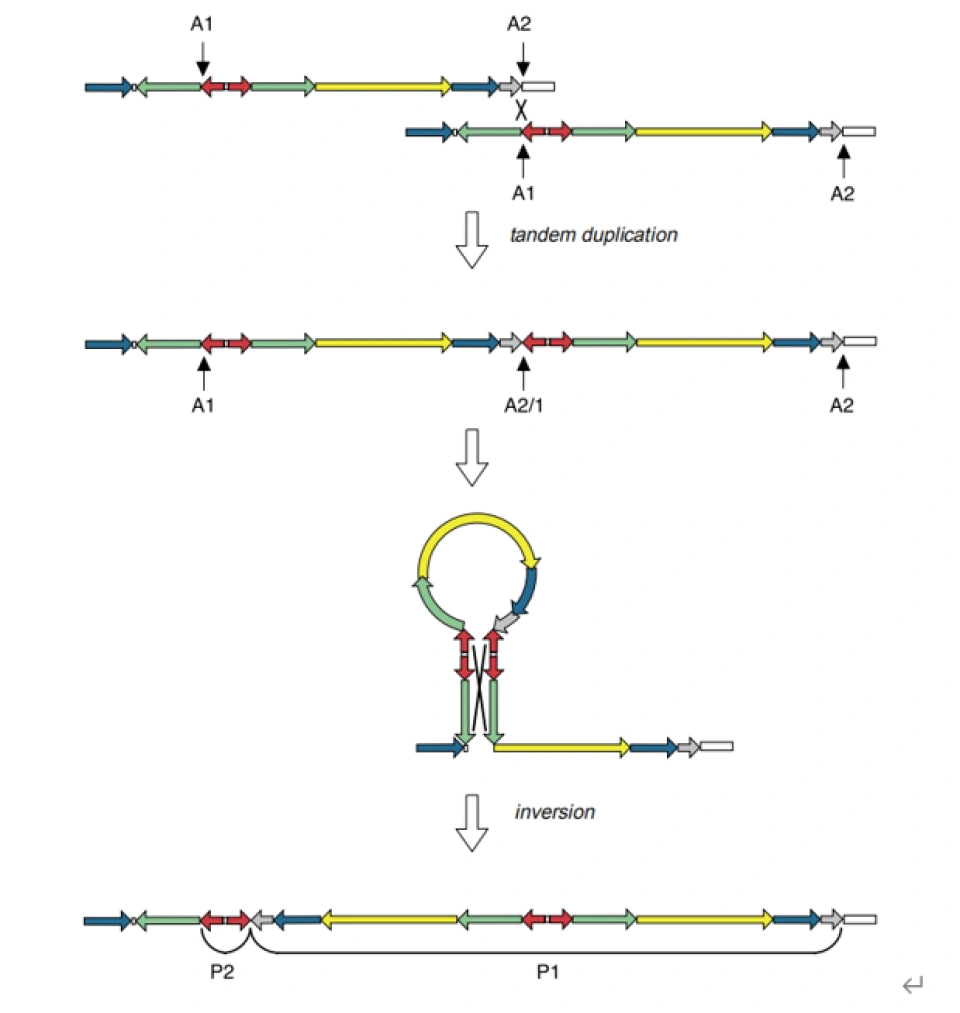
其可能的形成机制:
它们包围着9个多拷贝基因(即在Y染色体上出现多个克隆的基因,如DAZ(deleted in azoospermia)基因在Y染色体上重复出现了4次)的家族,这些基因很多是睾丸组织特异性表达的:
TSPY(testis-specific protein Y),重复35次;
VCY(variable charge Y),重复2次;
XKRY(XK-related Y),重复2次;
CDY(chromodomain Y),重复4次;
HSFY(heat shock transcription factor Y),重复2次;
RBMY(RNA-binding motif Y),重复6次;
PRY(PTP-BL-related Y),重复2次;
BPY2(basic protein Y 2),重复3次;
DAZ(deleted in azoospermia),重复4次。
为什么会扩增/多拷贝?解释之一是,提高这些基因的表达剂量(与X染色体不同,由于这些基因是男性特异性的,所以它们不会受到剂量补偿机制的约束)。解释之二:重复多次意味着为生殖细胞提供了恰当的核染色质环境,也就是说,保护了这些基因。这也许能顺带解释回文的出现。
其实老早就有人指出,回文序列对于维持男性性别决定基因的相对稳定起到了重要作用。由于人类与大猩猩在Y染色体的回文结构上的差别已足够大,几乎可以认定回文结构的形成至少在人类和大猩猩分支之前,而那是超过600万年前。如果这纯粹是基因突变的结果,那么是不是可以说回文结构的两侧,应该也发生相当或更大程度的分化呢?但实际情况却正如上面揭晓的那样。但并不只是回文有这种反常现象。Rozen等人在2003年研究发现,至少有6个扩增子区的起源早于人类与大猩猩的分支,但它们的异化程度却看上去就像这是10万年内才发生的事情。
显然存在使这些回文保持一致并降低Y染色体上这些扩增子基因的分化程度的机制。Rozen和Skatetsky不约而同地用基因转换(gene conversion)来描述这一机制。或者更通俗地说,Y染色体在自己跟自己发生交叉互换。什么?好吧。回文区内部或附近的重复序列的同源重组发生得非常频繁,以至于为回文的扩张提供了可能性。在人类基因组内最大、两臂一致性最高的回文P¬1(在自然界也是屈指可数的)中,我们相信,基因转换是维持这些基因的功能的重要机制。
解释之三,是性别对抗选择(sexually antagonistic selection),即性别特异的染色体(比如Y染色体)倾向于积累对该性别的个体有利(从而对其他性别的个体不利)的基因。具体地说:
1.对雄性有利的基因单独在Y染色体上积累(对雌性有利的基因单独在W染色体上积累)。X与Z染色体的情况复杂一些;
2.在同型配子的生殖中积累显性基因,在异型配子生殖中积累隐性基因;
3.出现性别特异性表达的基因,并且这些基因因为某些条件出现扩增和富集;
不过,原始的性别对抗理论对利雌性基因的出现的预测,与数据不符。科学家们原先预测X染色体上也将出现有利于雌性的扩增子基因,但观察显示事实并非如此。几乎所有已知的扩增子区域都是睾丸特异性表达的,意味着两性间的进化对抗可能并不是均等的。
扩增子的出现还可能与一种偏分离(segregation distortion)有关。对于性染色体来说,偏分离基因意味着改变性别比例。在两性生理分异的研究中,SRY,SF-1与Dax1的剂量关系可以为我们提供理解这一现象的参考。如果Dax1先于SRY和SF-1表达或者过多地表达,将引起计量敏感型性反转(DSS)。但Fisher(1930)和Nur(1974)都先后估计,任何首个偏分离基因的出现都会赋予第二个导致相反的偏分离基因以进化意义——这就是Fisher原理——除非非平衡的性别比例拥有着更多的进化优势。从某种性别对抗选择的观点来看,如果因为出现利雌或利雄的基因进而使雌性或雄性数量增加,这种竞争随着Y染色体的异化而持续进行,那么一场进化军备竞赛(evolutionary arm race)将可能在两条性染色体之间展开。事实上,雄性性别决定的一系列基因(包括SRY、M33、insr/igfr1、WNT4、AMH以及无精子因子(AZFa;b;c;d))中有任一出现差错,就可以导致染色体男性(XY)的人性反转成女性。在决定雄性分异方向和决定雌性分异方向的基因中,有不少是相互抑制、对抗的。在这个基础上,因为Y染色体作为一个特例从常染色体中分化出来,并形成了XX/XY的性别决定结构,我们可以推测为什么观察不到利雌扩增子基因的缘由,即所谓“利雌的基因”,可能是以阻碍Y染色体向着雄性分异的方向进化的形式存在的。
种种迹象都表明,扩增子及回文结构存在的理由并不是唯一的,并且我们不能根据某个预测与事实不符而否定上面提到的任何理论的全部。扩增子序列的发现导致的直接结果是对Y染色体进化的重新思考,进而为关于Y染色体未来的争论埋下了伏笔。
Key publications & References
[1] He, Xionglei and Zhang, Jianzhi (May 2016) X-Chromosome Dosage Compensation. In: eLS. John Wiley & Sons, Ltd: Chichester DOI: 10.1002/9780470015902.a0026517
[2] 王培林,《遗传病学》,人民卫生出版社,2000
[3] 赵跃华, 贡昌春, 李璞. 赖昂假说和性染色体变化[J]. 国外医学.遗传学分册, 1986(4).
[4] Lahn BT, Page DC. Four evolutionary strata on the human X chromosome.Science 286: 964-967
[5] R John, Aitken, Jennifer A, Marshall Graves. The future of sex[J]. nature, 2002, 415(6875):621-625.
[6] Jain, M., Kalsi, A. K., Kumar, P., & Halder, A. (2017). The Human Y Chromosome. Basics of Human Andrology, 77–98. doi:10.1007/978-981-10-3695-8_7
[7] Bellott, D. W., & Page, D. C. (2009). Reconstructing the Evolution of Vertebrate Sex Chromosomes. Cold Spring Harbor Symposia on Quantitative Biology, 74(0), 345–353. doi:10.1101/sqb.2009.74.048
[8] Skaletsky H , Kuroda-Kawaguchi T , Minx P J , et al. The male-specific region of the human Y chromosome is a mosaic of discrete sequence classes[J]. Nature, 2003, 423(6942):825-837.
[9] Ohno S (1967) Sex Chromosomes and Sex-Linked Genes. New York:Springer-Verlag.
[10] Kuroda-Kawaguchi T , Skaletsky H , Brown L G , et al. The AZFc region of the Y chromosome features massive palindromes and uniform recurrent deletions in infertile men[J]. Nature Genetics, 2001, 29(3):279-286.
Figure origins
第5面:Ref.[8]
第6面上:张勇, 邱文元. Y染色体的回文结构与男性生育[J]. 生命的化学, 2005(06):43-45.
第6面下:Ref.[10]
【本文为耀星会的原创作品,未经允许,禁止盗用、转载、篡改文章,否则耀星会和作者将追究版权责任。】


![[s-70]](https://www.bokeyuan.net/pic/image/emoji/cas/70.png)
![[s-3]](https://www.bokeyuan.net/pic/image/emoji/cas/3.png)











